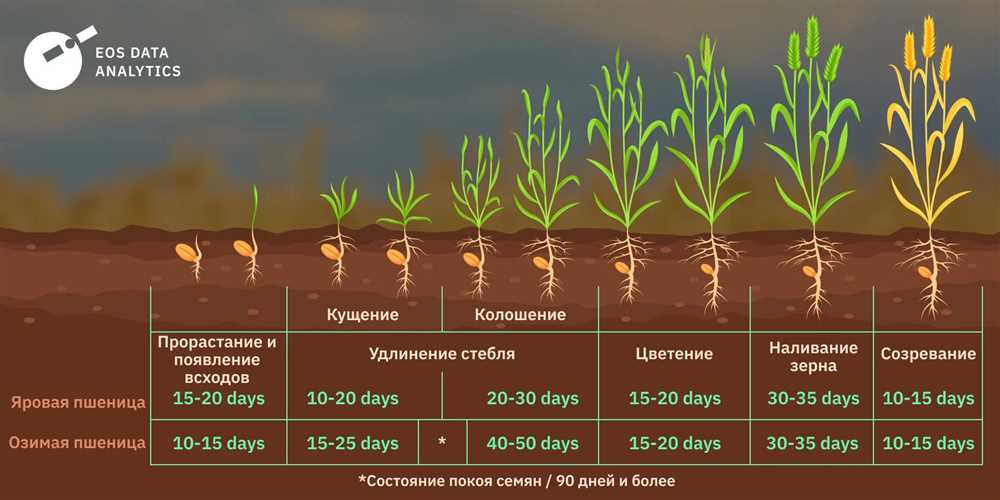
Понимание электронных конфигураций: ключ к пониманию химических элементов
В мире химии электронные конфигурации атомов играют решающую роль. Они определяют химические свойства элементов, их взаимодействия и способность образовывать соединения. В этой статье мы рассмотрим, что такое электронные конфигурации, как они формируются, и как их можно применить для понимания химических элементов.
Значение электронных конфигураций в химии:
Электронные конфигурации атомов определяют распределение электронов по энергетическим уровням в атоме. Это распределение имеет прямое влияние на химические свойства элементов. Важно понимать, что атом стремится к наименьшей энергии, что отражается в его электронной конфигурации.
Как строится электронная конфигурация:
1. Правило заполнения подуровней.
- Подуровни электронной оболочки обозначаются s, p, d и f. Они имеют разное количество электронов: s - 2, p - 6, d - 10, f - 14.
2. Заполнение электронами.
По правилу Ауфбау принято начинать заполнение с уровня с наименьшей энергией и последовательно двигаться к уровню с наибольшей энергией.
Принцип Паули утверждает, что каждый электрон в атоме имеет уникальный набор квантовых чисел.
Правило Хунда гласит, что при заполнении подуровней каждый орбитальный электрон стремится занять свободную орбиталь с минимальной энергией, прежде чем образовать пару.
Практическое применение электронных конфигураций:
1. Понимание химических свойств элементов.
- Электронная конфигурация определяет химическую активность элемента и его способность к образованию соединений.
2. Предсказание реакций.
- Знание электронных конфигураций позволяет предсказывать, как элементы будут реагировать друг с другом, образуя соединения.
3. Разработка новых материалов.
- Успешное применение электронных конфигураций в химическом проектировании способствует разработке новых материалов с желаемыми свойствами.
Примеры электронных конфигураций:
1. Водород (H) - 1s¹
- Водород имеет один электрон в s-орбитали первого энергетического уровня.
2. Кислород (O) - 1s² 2s² 2p⁴
- Кислород имеет два электрона в s-орбитали первого уровня, и шесть электронов - в s- и p-орбиталях второго уровня.
3. Железо (Fe) - [Ar] 3d⁶ 4s²
- Железо имеет электронную конфигурацию, основанную на аргоновом ядре, а затем 3d⁶ 4s² на более высоком энергетическом уровне.
Понимание электронных конфигураций атомов является фундаментальным для изучения химии. Оно позволяет углубленно понимать химические элементы, их свойства и взаимодействия, что в свою очередь является ключом к развитию новых материалов и технологий.